Sind Batterien sicher?
Wie wichtig weitere Verbesserungen sind, um aus nobelpreiswürdiger Forschung ein kommerziell erfolgreiches Produkt zu machen, zeigte sich vor etwa zehn Jahren: Anfang der 2010er-Jahre machen in den sozialen Medien Aufnahmen von Smartphones oder Tablets die Runde, deren Lithiumionen-Akkus sich plötzlich so stark erhitzten, dass es zu Brandschäden kam. Nachdem im Oktober 2013 ein Tesla S nach einem Unfall in Brand geraten war, ließ das den Börsenwert des US-amerikanischen Autobauers um rund 3 Milliarden US-Dollar einbrechen.
Weltweite Aufmerksamkeit hatte das Thema bereits im Januar desselben Jahres erlangt: Im Abstand von wenigen Tagen kam es bei zwei Flugzeugen des Typs Boeing 787 „Dreamliner“ zu Bränden der eigens für dieses Modell neuentwickelten Lithium-Ionen-Akkumulatoren. Die US-amerikanische Flugaufsicht FAA verlangte daraufhin einen Nachweis, dass die Batterien sicher betrieben werden können. Behörden in anderen Teilen der Welt zogen nach, ein praktisch weltweites Flugverbot für den Dreamliner war die Folge. Erst als Boeing die Flieger mit einem neuen Batteriesystem ausgerüstet hatte, durften sie von April an wieder abheben.
„Für die Lithiumionenbatterie als Technologie war das damals ein recht kritischer Moment. Sie lief Gefahr, vom Verbraucher als unsicher abgelehnt zu werden“, sagt Guido Skudlarek, der bei Evonik das Geschäft mit Spezialoxiden leitet. Weltweit setzten die großen Batteriehersteller die weitere Verbesserung der Sicherheit daher ganz oben auf ihre Prioritätenliste.
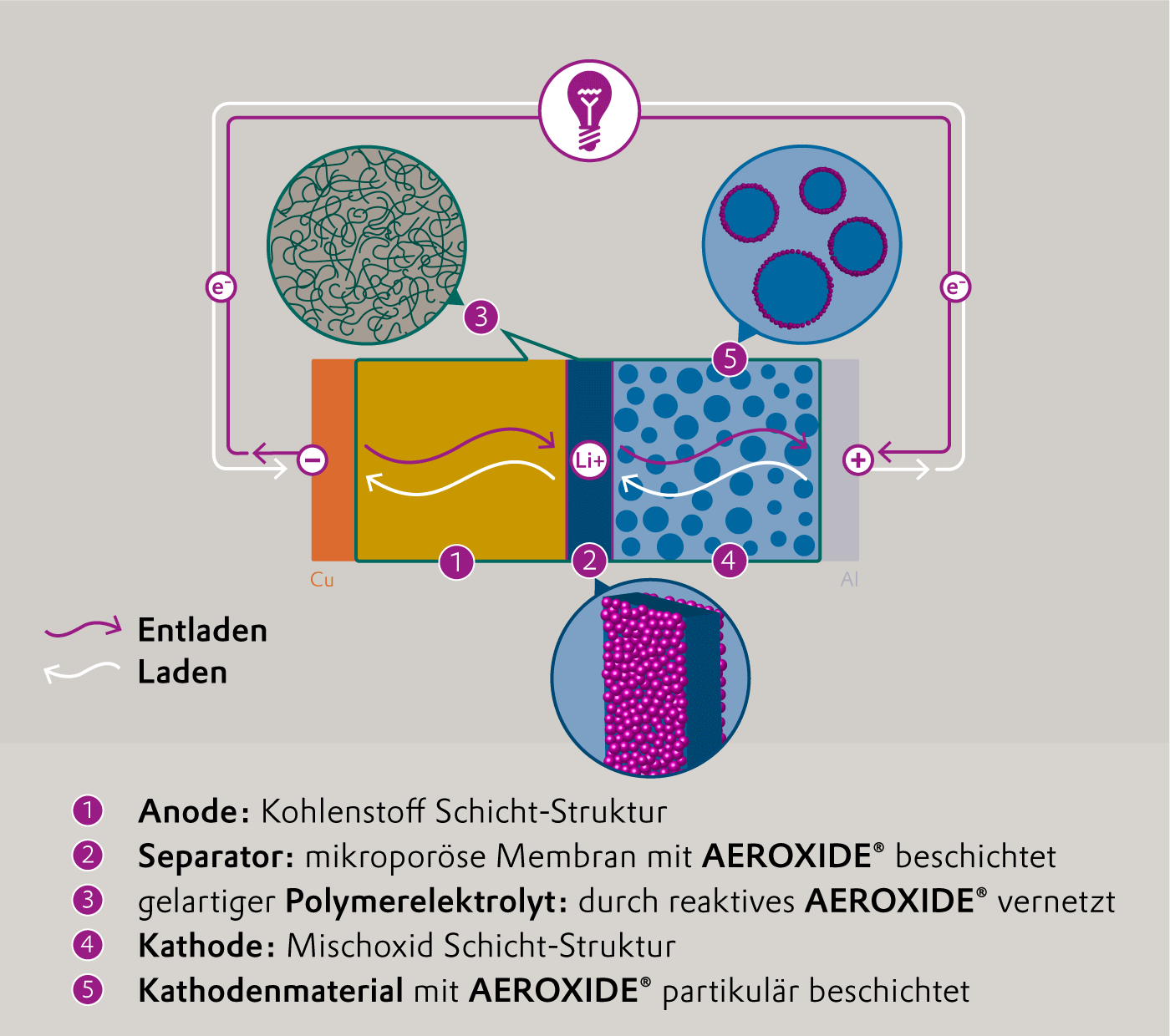
Relativ schnell stand damals die Frage im Raum, wie der Separator verbessert werden kann. Dabei handelt es sich um eine dünne, mikroporöse Folie, die beide Elektroden elektrisch voneinander isoliert, Ionen jedoch möglichst ungestört von Pol zu Pol wandern lässt. In Lithiumionen-Batterien bestehen die Separatoren meist aus thermoplastischen Kunststoffen wie Polyethylen und/oder Polypropylen. „Diese Materialien sind nur begrenzt wärmebeständig. Unter Hitzeeinwirkung schrumpfen sie“, erläutert Skudlarek. Stehen die Elektroden dann in unmittelbarem Kontakt zueinander, kann es zum Kurzschluss und zum thermischen Durchgehen der Batterie kommen.
Was Additive leisten können
Keramische Beschichtungen mit pyrogenen Metalloxiden wie AEROXIDE® verhindern genau das. Sie verbessern die thermischen und mechanischen Eigenschaften des Separators. Überhitzt die Batterie, schließen sich zuerst die Mikroporen in der Kunststoff-Membran und unterbrechen den Fluss der Lithiumionen. Die AEROXIDE®-Beschichtung verhindert zusätzlich das Schrumpfen der Separator-Folie und somit den direkten Kurzschluss der Batterie. Statt spektakulär in Flammen aufzugehen, versagt der Energiespeicher einfach seinen Dienst und kühlt langsam wieder ab. Inzwischen gibt es Überlegungen, den Separator nicht länger zu beschichten, sondern die Metalloxide während des Herstellprozesses direkt in die Membran einzuarbeiten, sodass sie später gleichmäßig in der gesamten Folie verteilt sind. „Da der Beschichtungsvorgang entfällt, wäre dieses Verfahren besonders ressourceneffizient“, sagt Skudlarek. Gleichzeitig könnten die Energiespeicher noch dünner gebaut werden und bräuchten weniger Platz – gerade bei mobilen Anwendungen ein wichtiger Gewinn.
Nicht nur der Separator, auch die Elektroden sind weiter verbessert worden. An der Anode kommt inzwischen nicht mehr Petrolkoks, sondern eine Mischung aus Graphit und Silizium zum Einsatz. Und die Kathode wird heutzutage nicht mehr aus reinem Kobaltoxid gefertigt. Stattdessen besteht sie aus Mischoxiden, die neben Kobalt auch Mangan und Nickel enthalten. In der neuesten Generation dieser Nickel-Mangan-Kobalt- (NMC-) Kathodenaktivmaterialien sinkt der Kobalt-Anteil in der Kathode auf nur noch zehn Prozent. „Der Trend geht zu immer höheren Nickelgehalten, um die Energiedichte weiter zu steigern. Dadurch wird das Material jedoch strukturell instabiler und die Oberfläche noch reaktiver“, stellt Skudlarek fest. Auch hier können die AEROXIDE® Additive von Evonik helfen. Werden die NMC-Partikel mit einer hauchdünnen Schicht aus nanostrukturiertem Aluminiumoxid (Al2O3) und/oder Titandioxid (TiO2) umgeben, so reagiert dieses künstliche Interface mit dem Elektrolyten und bildet eine schützende Hülle, die Lithiumionen passieren lässt, aber gleichzeitig die NMC-Materialien vor vorzeitigem Zerfall schützen. So behält die Batterie über den gesamten Lebenszyklus hinweg eine höhere Kapazität.
Für mehr Sicherheit sorgen Verbesserungen im Bereich des Elektrolyten. Bisher sind flüssige Elektrolyten verbreitet, zum Beispiel in aprotischen Lösungsmitteln gelöste Lithiumsalze wie das giftige Lithiumhexafluorophosphat (LiPF6). Nachvollziehbar, dass Batteriehersteller nach Möglichkeiten suchen, ein Auslaufen des Elektrolyten bei beschädigten Batteriezellen zu verhindern. Gelingen kann dies beispielsweise mit einer speziellen oberflächenmodifizierten Form von AEROXIDE®. Das Additiv wird wie bisher als keramische Beschichtung auf den Separator aufgebracht. Dank seiner besonderen Eigenschaften reagiert es jedoch mit einem weiteren Bestandteil in der Elektrolyt-Lösung. Indem sich dieser Stoff quervernetzt, wandelt sich die reaktive Flüssigkeit zu einem gelartigen Elektrolyten auf Polymer-Komposit-Basis, so dass die Sicherheit der Lithium-Ionen-Batterie weiter erhöht wird.
Seit den ersten Schritten in den 1970er-Jahren hat die Technologie für Lithiumionen-Batterien riesige Fortschritte gemacht. Heute scheint sie so ausgereift, dass einige Fachleute nur noch begrenzte Möglichkeiten zur Weiterentwicklung sehen. Bis zur nächsten Generation von kleinen, leistungsfähigen Energiespeichern, wie zum Beispiel Feststoffbatterien, wird es jedoch noch Jahre dauern.
Die Lithium-Ionen-Batterien sind entscheidend für den Aufstieg saubererer Energietechnologien und der Elektromobilität und helfen, den Ausstoß von Klimagasen zu beschränken. Dabei sind sie inzwischen im besten Sinne alltäglich geworden. Sie finden sich nicht nur in U-Booten und Satelliten, sondern auch in elektrischen Zahnbürsten, Herzschrittmachern oder Hausversorgungen. „In meinen Augen macht das den Nobelpreis für die Batterieforscher zu etwas Besonderem“, sagt Evonik-Manager Skudlarek. „In der Vergangenheit sind häufig Grundprinzipien ausgezeichnet worden, die versteckt mit Produkten oder Prozessen in Verbindung stehen oder sehr spezifische Entwicklungen, die uns nur hin und wieder in unserem Leben begegnen. Das ist diesmal anders.“
Infografik: KNSKB+
ERSCHEINUNGSTERMIN
9. DEZEMBER 2019

Innovationsforschung
Fortschritt durch Kooperation
Biochemikerin Zee Upton erklärt, wie beide Seiten davon profitieren, wenn Evonik-Fachleute auf Wissenschaftler treffen.

Interview mit Walter Leitner
Nachhaltige Chemie durch Power-to-X
Professor Leitner erläutert, wie das Power-to-X-Konsortium Strom aus erneuerbaren Energien speichern und nutzen will.

Erneuerbare Energien
Effektive Kopplung, erfolgreiche Energiewende
Plädoyer: Wärme, Mobilität und Elektrizität müssen künftig stärker gekoppelt werden.

TEG-Generator
Heisse Stromquelle
Überall geht Abwärme als Energie verloren – moderne TEG-Generatoren verwandeln sie in Strom.
